星标“医工学人”,第一时间获取医工交叉领域新闻动态~

大脑,是人体中极其复杂的结构,其功能并非源自孤立的区域,而是由数十亿神经元构成的分布式网络协同运作。发表于《Nature BME》的一篇文章,为我们带来了一项突破性的研究成果,由苏黎世联邦理工学院和纽约大学的科学家们组成的联合团队,开发出一种名为“全息经颅超声刺激”(hTUS)的技术,它能够利用精心编排的声波,以前所未有的效率和精度,同时激活大脑中的多个目标区域,真正实现了对分布式神经网络的协同调控。

传统经颅超声刺激(TUS)技术在精准调控大脑功能方面潜力巨大,但长期以来受到两大限制:
1.时空控制精度不足:传统的单点超声换能器,其焦点大小会随着频率的改变而变化,这使得研究人员难以独立评估频率或刺激区域大小对神经元的具体影响。此外,在小型动物模型(如小鼠)上使用为人类设计的低频超声时,往往会刺激到过大的脑区,影响了实验的精确性。
2.对网络效应的忽视:以往的研究主要集中于单点刺激,忽略了大脑作为一个复杂网络,其内在的连接和相互作用对超声神经调控效果的贡献。
为了解决这一挑战,该研究团队开发了一套高度集成的刺激-监测系统——全息经颅超声刺激(hTUS)神经调控系统,其核心是一个包含512个独立阵元的球面超声换能器阵列,如同一顶高科技头盔,紧密贴合实验小鼠的头部。
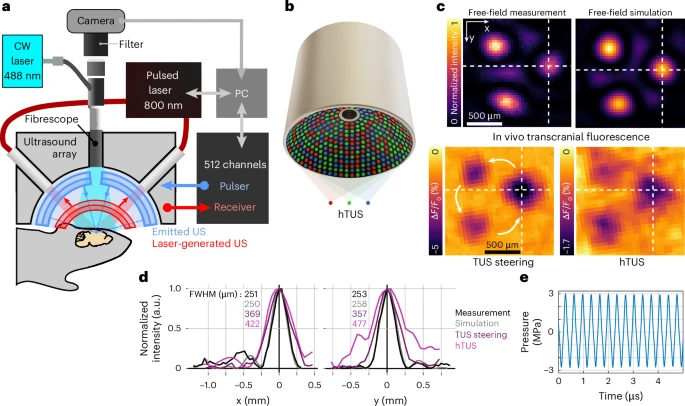
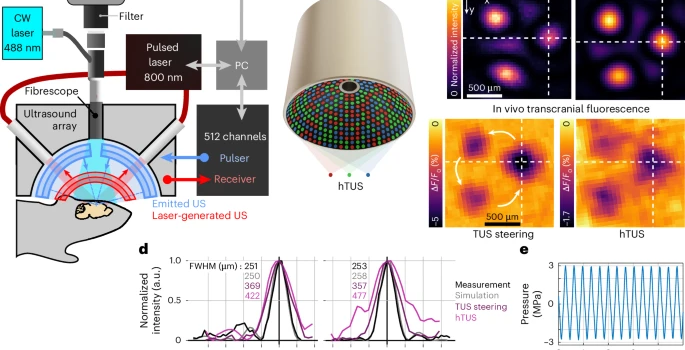
图1:对小鼠大脑进行非侵入性、精准且高度可控的超声波扰动输送。开发了集成超声刺激-光声成像-钙信号监测的三模态系统,512元球面阵列实现精准hTUS刺激(3MHz,FWHM=0.7mm),经颅压力达1.9MPa。首次实现非侵入、高空间精度(亚毫米级)的脑区靶向超声调控,为神经调控提供新工具。
这项技术的真正创新性之处在于“全息”二字。通过精确计算和控制每个阵元发射声波的时间延迟,系统可以在大脑内部的任意位置,同时生成多个、高分辨率的超声焦点,组合成特定的几何图案,如三角形或五边形。这并非视觉上的3D投影,而是一种声学能量的精准塑形,实现了从单点到多点阵列的飞跃。
为了验证效果,该系统还集成了一套宽场荧光钙成像设备,通过植入头骨的纤维内窥镜,实时捕捉神经元活动时产生的钙离子信号,这使得研究人员能够亲眼“看见”他们用声波“雕刻”出的大脑活动模式。
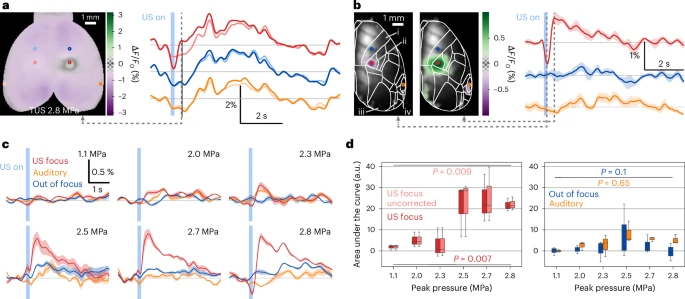
图2:经颅超声刺激(TUS)诱发局部神经反应。TUS在体感区诱发局部钙信号(ΔF/F>15%),离焦点响应衰减50%,听觉皮层无激活;压力≥1.2MPa时信号显著增强(p<0.05),证实超声可选择性激活特定脑区,且效应具有压力依赖性,排除听觉伪迹干扰。
实验结果极为震撼。在使用传统的单点TUS刺激小鼠的体感皮层时,研究人员发现需要将峰值压力提升至2.5兆帕(MPa)以上,才能稳定地观察到神经元的激活响应。然而,当切换到hTUS模式,用一个三角形图案同时刺激三个相距0.5毫米的皮层位点时,奇迹发生了,仅仅在0.9MPa的极低压力下,系统就记录到了清晰的神经激活信号;当压力提升至1.2MPa时,其激活强度已经与2.8MPa的单点刺激相当。这意味着,通过协同招募分布式神经元,hTUS将激活大脑网络的能量阈值降低了整整一个数量级。
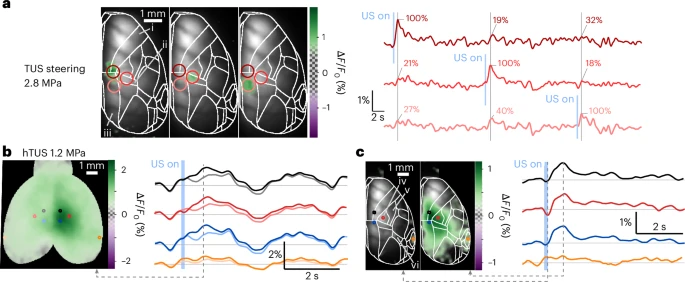
图3:经颅超声波前整形技术实现分布式网络的动态探测。波束偏转TUS能在30秒内动态激活运动区(荧光幅度100%)、体感区(72%)和压后皮层(58%),hTUS使响应区域扩大2.3倍,说明超声波前整形技术可实现多脑区时序可控刺激,hTUS更适合分布式网络调控。
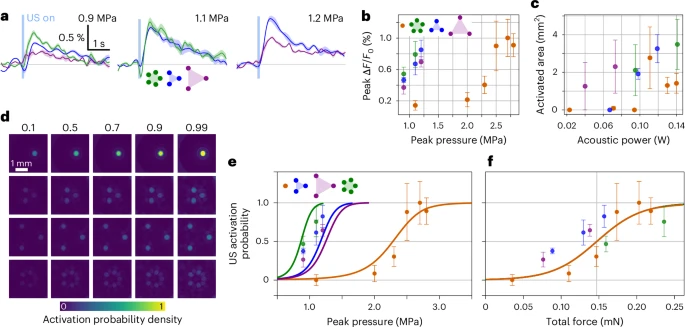
图4:高能靶向超声(hTUS)有效激活神经网络。hTUS比传统TUS激活面积大1.8倍(p<0.01),1.5MPa时诱发动作电位数量增加3倍;AMPA突触电流维持网络同步放电,数据证实hTUS通过协同突触传递增强网络响应,为神经环路研究提供新方法。
为何同时刺激多个点会产生如此巨大的效率提升?为了揭示其背后的神经机制,团队构建了一个“简化皮层网络模型(sCNM)”来进行模拟。模型揭示了网络协同的奥秘:
1、单点刺激:当一个超声焦点激活单个网络节点时,该节点虽然会产生动作电位,但它传递给下游其他节点的突触后电流非常微弱,不足以将邻居们也“唤醒”。
2、全息刺激:当hTUS同时激活网络中的多个节点时,每个节点都会接收到来自多个上游节点的突触输入。这些输入信号会发生汇聚和叠加,产生强大的突触后电流,从而极大地增强了初始反应。这种正反馈效应使整个被刺激的网络迅速进入一种持续的、高频的放电状态,产生了宏观上可被轻易观测到的强烈信号。
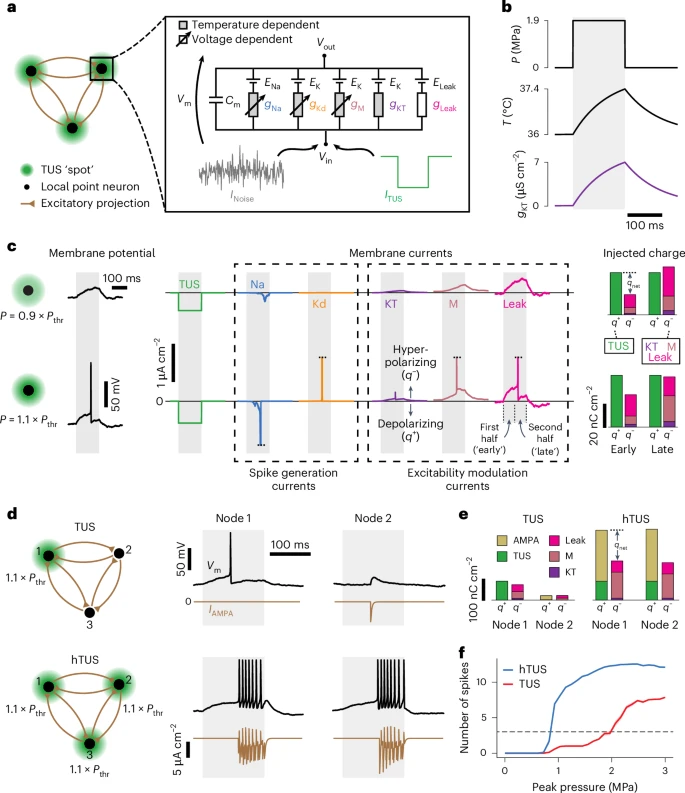
图5:sCNM预测TUS与hTUS的差异响应阈值。模型显示hTUS刺激下,KT电流使晚期超极化电荷增加37%,但AMPA电流补偿维持去极化(电荷净增1.4倍)。理论预测hTUS阈值比TUS低22%,阐明热激活钾电流与突触整合的协同机制。
简而言之,hTUS的成功在于它将多个微弱的“单点”有效连接成相互作用的“多点阵列”,利用大脑自身的网络连接来放大刺激效果。
这项研究的意义远不止于一项技术的改进,它为我们理解和干预大脑开辟了全新的思路。
-
首先,它为神经科学家提供了一个强大的工具,能够以前所未有的精度去探测和操控负责高级认知功能(如学习、记忆和决策)的分布式大脑回路。
-
其次,该研究的物理模型(USEM)还指出,“总辐射力”——一个描述声波对组织综合作用力的参数——可能比传统的“峰值压力”更能准确预测神经激活效果,这深化了对超声与生物组织相互作用物理机制的理解。
-
更令人兴奋的是其巨大的临床潜力。通过以更低能量、更高效率的方式激活特定脑网络,hTUS有望为帕金森病、癫痫、重度抑郁症等神经及精神疾病的治疗,开发出更安全、更精准的无创疗法。
当然,该技术目前仍处于动物实验阶段,从在小鼠大脑中投射声学全息图,到真正应用于人类临床治疗尚需时日。但这项工作无疑已经给神经调控领域的前沿进展按下了“快进键”,引领我们进入一个可以通过精密编排的声波来修复和增强大脑功能的全新时代。
Estrada, H., Chen, Y., Lemaire, T. et al. Holographic transcranial ultrasound neuromodulation enhances stimulation efficacy by cooperatively recruiting distributed brain circuits. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01449-x
END
撰文 | 郝娅婷
排版 | 王可豪
审核 | 医工学人理事会
扫码加入医工学人,进入综合及细分领域群聊,
参与线上线下交流活动

推荐阅读
点击关注医工学人

本篇文章来源于微信公众号: 医工学人