星标“医工学人”,第一时间获取医工交叉领域新闻动态~

对于许多患有肥厚型心肌病(HCM)的年轻人来说,生命可能在毫无征兆的瞬间戛然而止。这种遗传性心脏病是导致心源性猝死的“隐形杀手”,而我们现有的医学指南在预测谁是下一个高危患者时,其准确率几乎等同于抛硬币。这使得医生们陷入两难:要么让患者承担不必要的风险,要么为他们植入昂贵且可能带来并发症的除颤器(ICD)。现在,来自约翰·霍普金斯大学的研究团队开发出一种名为MAARS的AI系统,它似乎拥有了洞察未来的能力。7月2日发表于《Nature cardiovascular research》的论文详细介绍了这项突破。MAARS不仅以惊人的准确性碾压了所有现行临床标准,更重要的是,它向我们展示了新一代医疗AI该有的样子:强大、公平且值得信赖。

MAARS的真正威力在于其“通才”能力。过去的AI模型往往只处理单一类型的数据,就像一个只懂一门外语的翻译。而MAARS则是一位精通多国语言的大师,它能同时阅读和理解三种截然不同的健康信息:患者的电子病历(如年龄、病史、症状),医生写的心脏超声和磁共振报告(如心脏大小、功能指标),以及最关键的——原始的三维心脏磁共振(CMR)图像 (图1)。
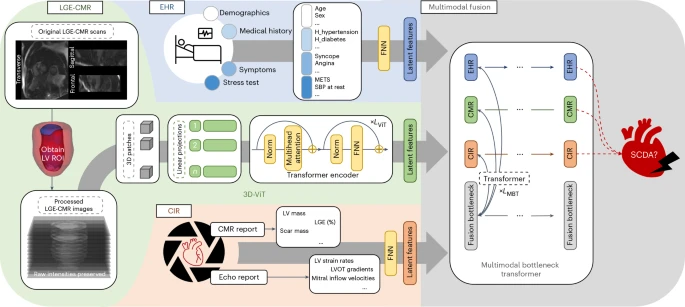
图1:MAARS的示意图概览。MAARS包含三个输入分支,分别对应三种输入类型:LGE-CMR图像(左中,绿色)、来自电子健康记录(EHR)的临床协变量(左上,蓝色)以及来自CIR(包括CMR和超声心动图报告)的测量数据(左下,橙色)。LGE-CMR图像经过处理获得左心室作为感兴趣区域(ROI),随后作为输入传递给3D-VIT。EHR和CIR协变量均为结构化表格数据,由专用的前馈神经网络(FNN)处理。三个输入分支网络的末端连接到一个多模态融合模块,该模块使用MBT(多分支变换器)融合知识并学习预测患者特定的SCDA(突发心脏死亡风险)评分。
“直接分析原始图像是这项工作的独特之处,”研究人员强调。传统方法依赖于放射科医生对图像的解读和量化,这个过程不仅有赖于经验,也容易产生误差和遗漏。MAARS则绕过了这一步,它利用一个先进的三维视觉转换器(3D-ViT)架构,像人眼一样直接“观察”心脏的三维结构,尤其是心肌上那些预示着风险的微小疤痕(即晚期钆增强区域)。这种方法能捕捉到人类专家可能忽略的、复杂的疤痕空间分布模式与未来心律失常风险之间的微妙联系。
随后,一个被称为“多模态瓶颈转换器”(MBT)的智能融合模块,会将从图像、病历和报告中提取的洞见整合起来,形成一个对患者风险的整体性、全局性判断。
结果是决定性的。如图2所示,在一个包含553名患者的内部测试中,MAARS预测猝死风险的准确率指标(AUROC)达到了惊人的0.89。相比之下,目前全球心脏病专家们依赖的ACC/AHA和ESC指南,其得分仅在0.54到0.62之间徘徊。为了证明自己不是侥幸成功,MAARS还在一个来自完全不同医疗系统、包含286名患者的外部队列中接受了考验,并取得了0.81的优异成绩,再次将传统方法远远甩在身后。
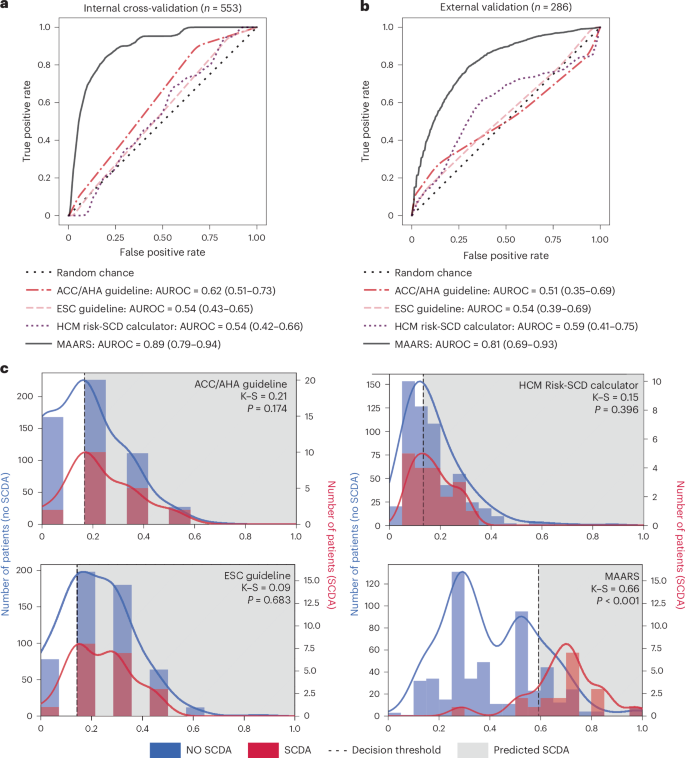
图2:MAARS和当前临床SCDA风险评估工具的性能评估。a. 受试者工作特征曲线(ROC)及曲线下面积(AUROC)值(数据以均值±95%置信区间表示),基于JHH-HCM队列(n=553)的内部五折交叉验证结果。b. 受试者工作特征曲线及AUROC值(数据以均值±95%置信区间表示),基于SHVI-HCM队列(n=286)的外部验证结果。c. 预测的SCDA(突发心脏死亡风险)评分分布图:蓝色柱状图及曲线代表未发生SCDA的患者,红色代表发生SCDA的患者。采用双样本Kolmogorov-Smirnov检验量化两组分布的差异并计算P值。虚线垂直线表示各预测模型的最佳决策阈值,阈值右侧灰色阴影区域标识被预测为SCDA高风险的患者。
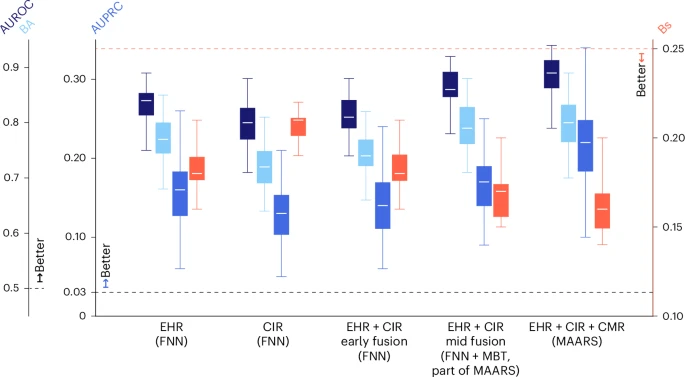
图3:数据模态叠加的效果分析。x轴上从左至右的箱线图簇展示了一系列数据-模型组合的性能表现:1. MAARS中的EHR分支网络(仅使用EHR临床协变量,FNN结构);2. MAARS中的CIR分支网络(仅使用CIR测量数据,FNN结构);3. 早期融合FNN(EHR与CIR数据拼接后输入单一FNN);4. 中期融合MAARS(EHR + CIR,FNN + MBT多模态融合);5. 完整MAARS模型(EHR + CIR + CMR多模态联合输入)。
更令人振奋的是,MAARS展现了卓越的“公平性”。临床数据显示,现有指南对不同性别和年龄段的患者,预测效果忽好忽坏。而MAARS则像一个经验丰富、毫无偏见的老医生,对所有患者都一视同仁,提供了持续稳定的高水平预测,如图4所示。
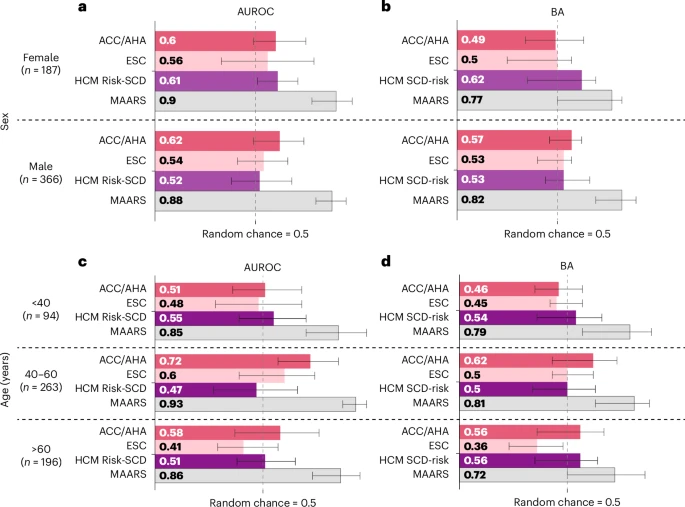
图4:不同患者亚组的性能表现。1. 性能对比:MAARS在AUROC和BA上均显著优于传统临床工具(ACC/AHA、ESC指南和HCM Risk-SCD计算器)。2. 误差范围:条形图上的须线表示95%置信区间(CI),基于内部队列的交叉验证结果计算。3. 亚组分析:性别:MAARS在女性(AUROC 0.9)和男性(0.86)中均表现优异。年龄:在51–65岁患者中性能最高(AUROC 0.93),>65岁群体性能稍低(0.66)。
在人命关天的医疗领域,一个无法解释自己“思考过程”的AI是难以被接受的。MAARS团队显然深谙此道。他们为MAARS配备了“可解释性”工具,让这个AI的决策过程变得透明。
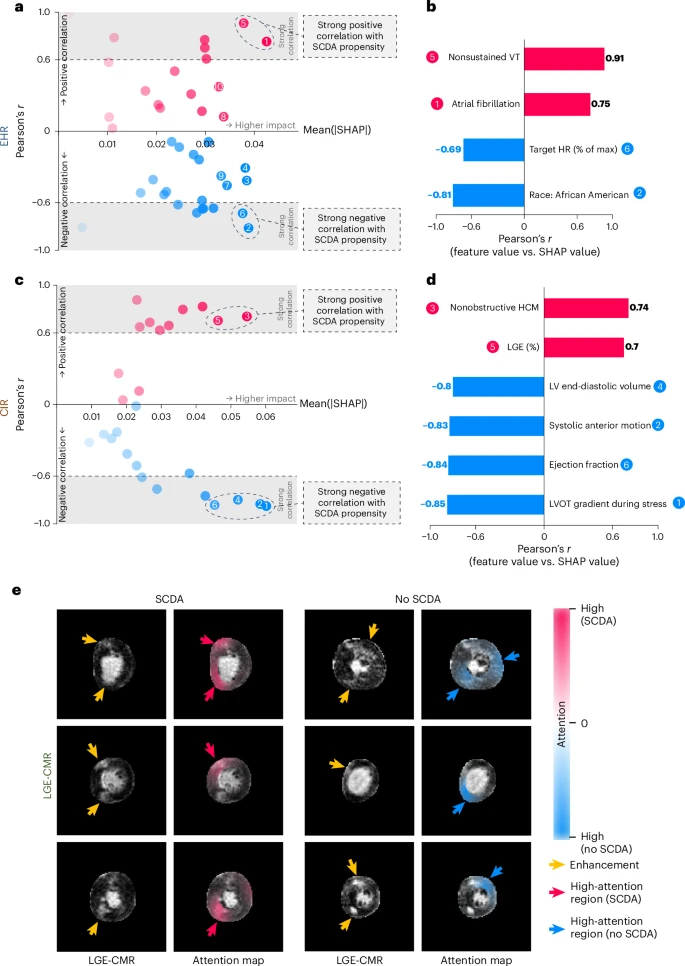
图5:模型可解释性。a. EHR分支临床协变量的Shapley值解析。b. EHR分支中高影响且强相关的协变量。c-d. CIR分支的Shapley值解析与关键协变量。e. LGE-CMR分支的注意力机制可视化。
借助Shapley值分析,医生可以清楚地看到,对于某位特定患者,是“心房颤动病史”还是“LGE(疤痕)占比”将其生命风险推高了。更有甚者,通过“注意力图”,AI能直接在心脏图像上用高亮标出它认为最可疑的区域。这不仅仅是为了赢得信任,更是为医生提供了宝贵的临床洞察,甚至可能揭示新的疾病机制。
当然,MAARS走向临床应用还有一段路要走。它需要更大规模的队列来验证,其对多种数据的依赖也可能构成推广的障碍。但毫无疑问,MAARS已经为我们描绘了未来精准医疗的蓝图:一个由AI辅助,能够更早、更准地识别风险,从而为每个生命提供最恰当守护的时代。
[1] Lai, C., Yin, M., Kholmovski, et al. Multimodal AI to forecast arrhythmic death in hypertrophic cardiomyopathy. Nature Cardiovascular Research, 4, 891–903(2025). https://doi.org/10.1038/s44161-025-00679-1
END
撰文 | 郝娅婷
排版 | 周宇茜
审核 | 医工学人理事会
扫码加入医工学人,进入综合及细分领域群聊,
参与线上线下交流活动

推荐阅读
Science Robotics | AI 手中的医用针头:向自主机器人导航迈进
点击关注医工学人
最新直播

本篇文章来源于微信公众号: 医工学人