星标“医工学人”,第一时间获取医工交叉领域新闻动态~

糖尿病是全球性慢性疾病,伴随高心血管疾病风险。当前连续葡萄糖监测(CGM)系统虽能追踪血糖动态,但仅依赖单一生物标志物,无法全面反映代谢状态或心血管风险。
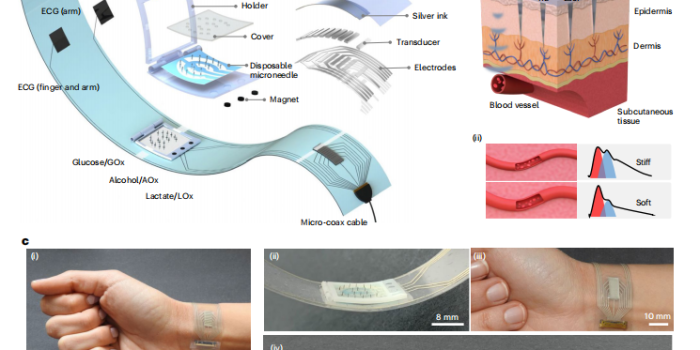
香港城市大学、加州大学圣地亚哥分校等团队在《Nature Biomedical Engineering》发表的突破性研究,提出一种名为“BLUE”(Biomarkers-Linked Ultrasound Electronic)的多模态腕带平台。该系统首次将微针阵列传感器与超声物理传感器集成于单一柔性腕带,实现葡萄糖、乳酸、酒精的实时化学监测,以及血压(BP)、心率(HR)、动脉硬度等心血管信号的同步捕获,为闭环糖尿病管理提供创新方向。

BLUE平台的核心是将实验室级功能浓缩于可穿戴设备中,解决柔性电子设备的应用悖论——即如何在保证透气性、防水性和生物相容性的同时,实现高精度信号采集。系统采用多层设计:
微针传感器层:800 μm长的SU-8微针穿透表皮至真皮层,直接接触间质液(ISF),通过功能化氧化酶(葡萄糖氧化酶、乳酸氧化酶、酒精氧化酶)实现电化学传感。
超声传感器层:10个柔性超声换能器(面积3×1 cm)阵列定位腕动脉,通过脉冲回波解码血管直径变化,计算血压和动脉硬度。
电路与接口层:聚对苯二甲酸乙二醇酯(PET)基底上丝网印刷银电路,结合近场通信(NFC)实现无线数据传输,整个系统无需电池,手机可激活。
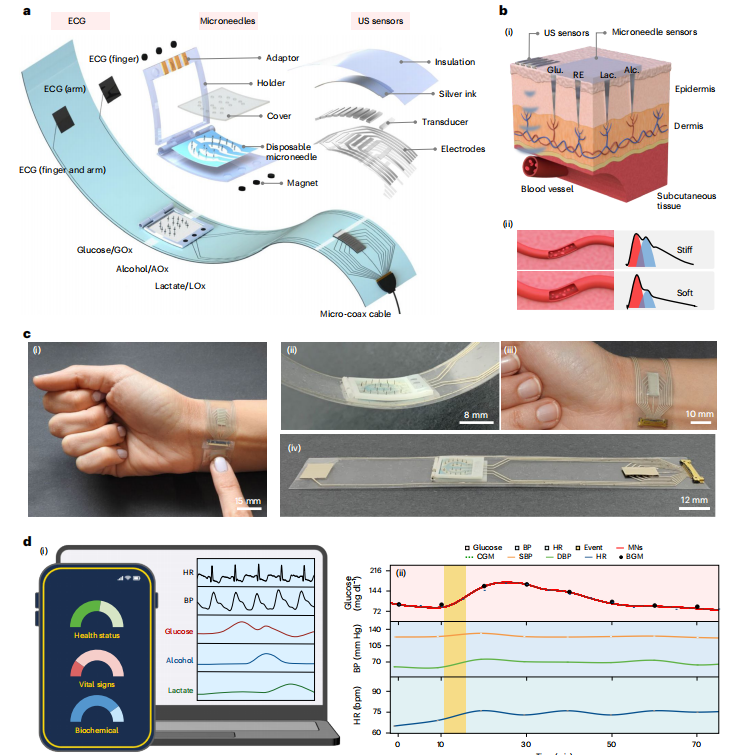
图1:用于同时跟踪化学生物标志物和物理信号的多模态BLUE平台概述。
为适应日常活动中的皮肤形变,团队通过预拉伸-溅射工艺开发可拉伸微针电极,在30%拉伸下电阻稳定性>95%(图2a)。微针采用3D打印模具与干法蚀刻技术结合,尖端直径优化至5–10 μm(蚀刻60分钟),确保无痛穿透且避免断裂:
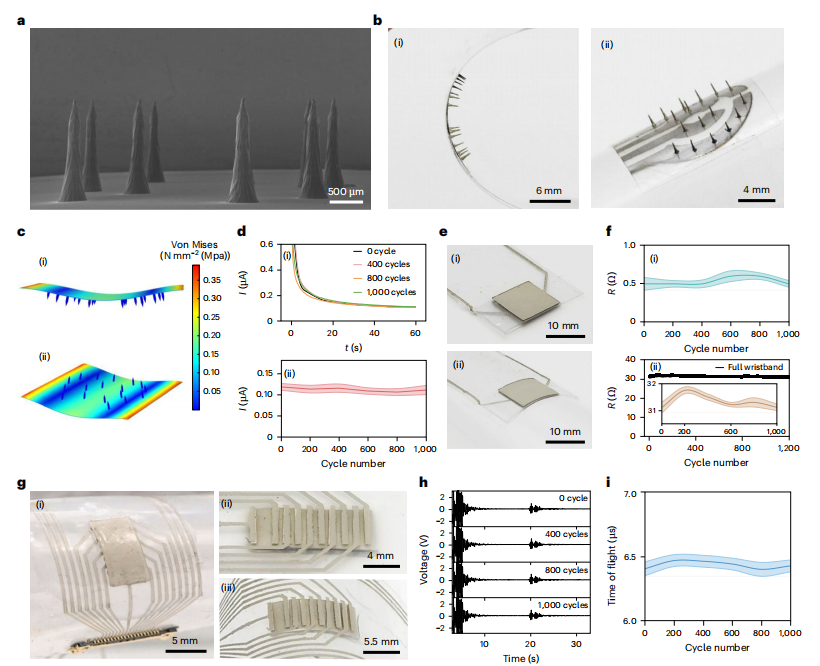
图2:传感平台的机械性能。
串扰控制是关键挑战。通过空间分离传感器(微针、ECG、超声间距>3 cm),并验证信号独立性:开启/关闭ECG和超声时,微针电流噪声峰值<2%(图3a-b);反之,生理信号不受电化学操作干扰(图3c-f)。
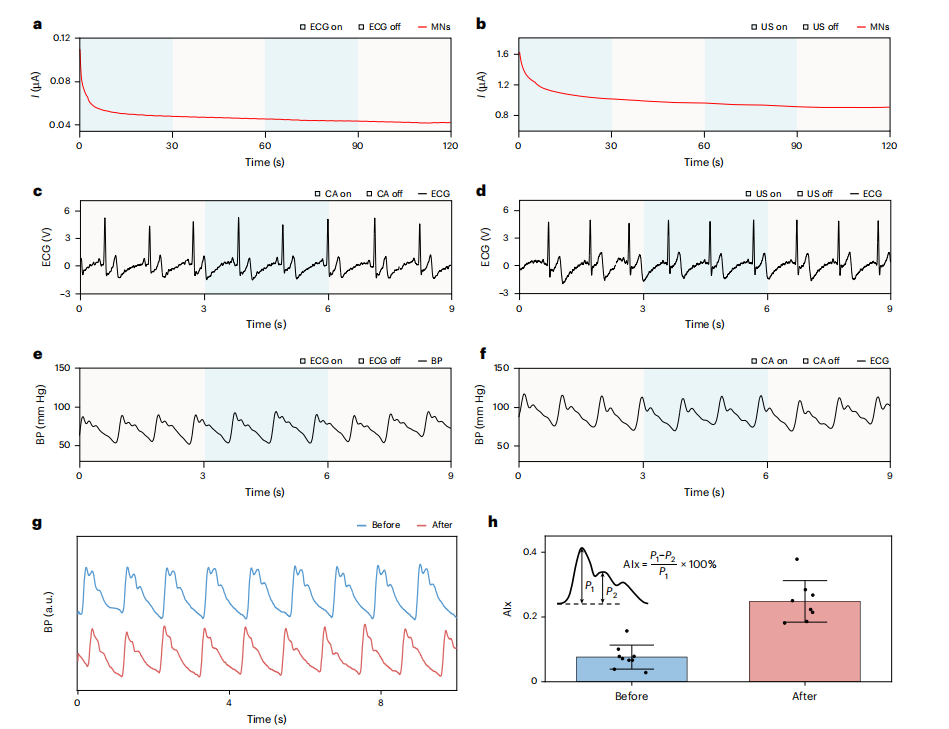
图3:单个传感器的监测和表征。
BLUE平台在11名健康参与者和前驱糖尿病患者中开展试验,揭示日常活动(进食、饮酒、运动)对代谢与心血管信号的耦合影响:
1)单刺激响应
进食:空腹>8小时后进食,血糖峰值更高(166 mg/dL vs. 133 mg/dL),伴随血压显著上升(132/80 mmHg vs. 127/71 mmHg),动脉硬度指数(AIx)降低,反映血管舒张(图4a)。
饮酒:非饮酒者酒精摄入后血压升高(78→109 mmHg),HR增加(62→70 bpm),而饮酒者无变化;微针酒精监测MARD=8.84%(vs. 商业化呼出气体分析仪)。
运动:非运动员乳酸清除率慢于运动员(10.22 mM→2.89 mM需30分钟),高强度运动诱发高血压(179/96 mmHg)和运动后低血压(131/49 mmHg)。
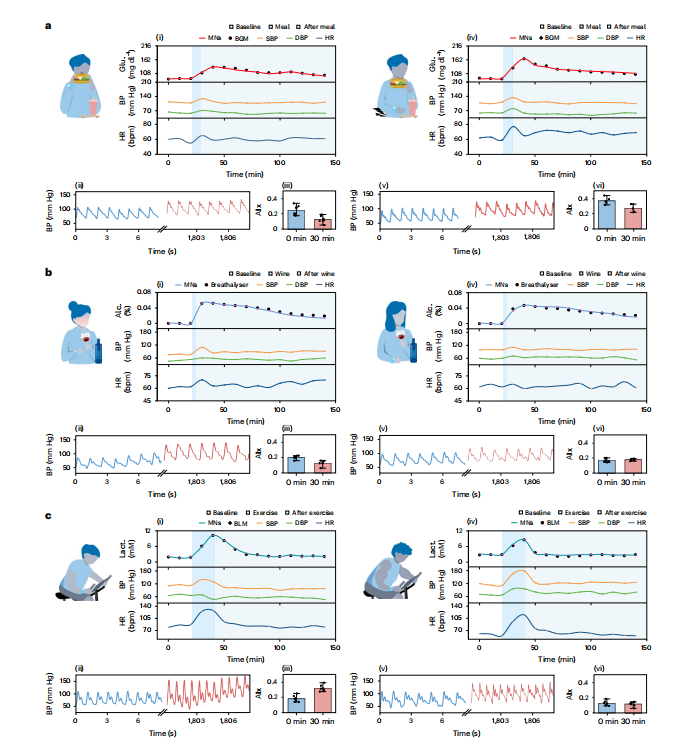
图4:血压以及不同生物标志物的体内监测。
2)多刺激协同监测
400分钟试验中(图5b),平台同步追踪餐后血糖上升、饮酒后酒精峰值(0.053%)、运动后乳酸激增(10.22 mM),并关联血压波动(餐后↑20 mmHg)和动脉硬度变化。多标志物监测精度:乳酸r²=0.98(vs. 血乳酸仪),血压r²=0.98(vs. 臂式血压计)。
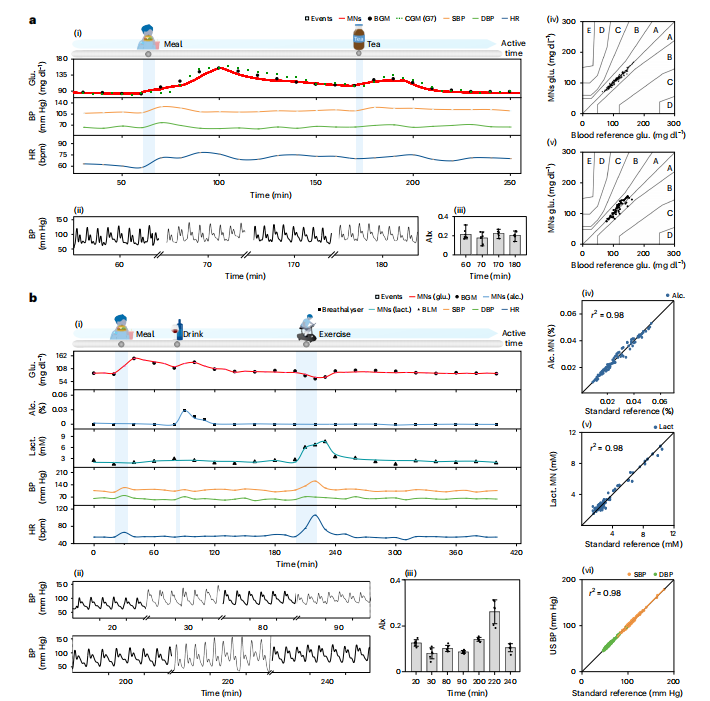
图5:不同日常活动期间扩展的同步体内血压监测以及多种生物标志物。
前驱糖尿病患者(空腹血糖100–125 mg/dL)试验显示独特代谢特征(图6):
乳酸清除延迟:餐后乳酸峰值更高(8.5 mM vs. 健康者5.2 mM),且恢复基线需>60分钟(vs. 健康者30分钟),反映代谢僵化。
心血管风险:酒精摄入后血压持续升高(>10 mmHg),动脉硬度(AIx=0.25±0.04)高于健康组(AIx=0.17±0.02)。
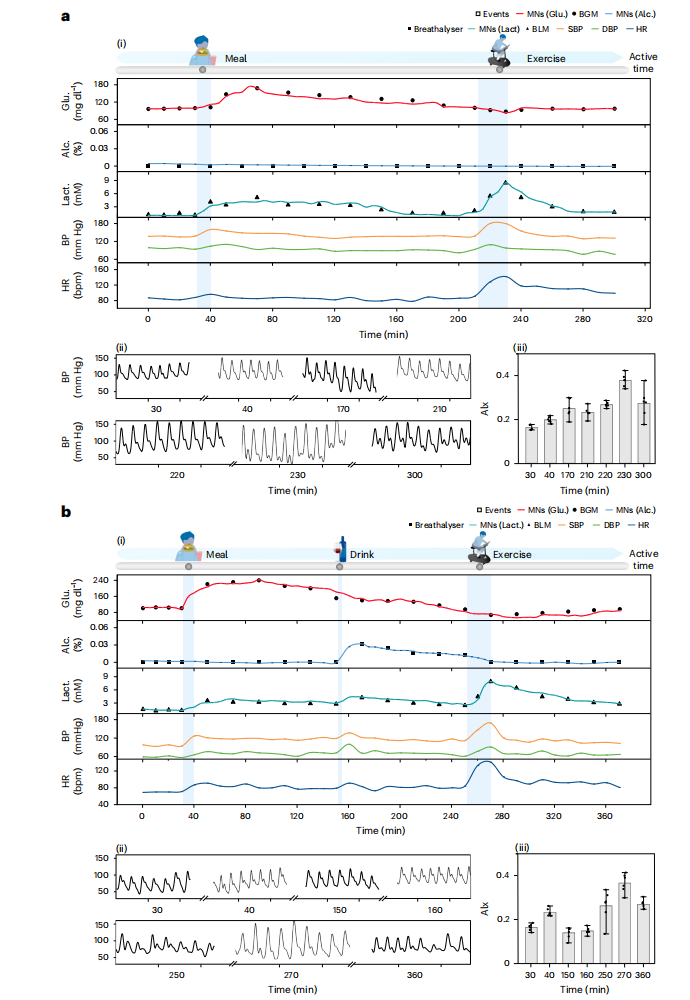
图6:不同日常活动中对高危糖尿病前期的血压以及多种生物标志物进行扩展的同步体内监测。
BLUE平台标志着糖尿病管理从单一葡萄糖监测迈向“代谢-心血管”多维闭环时代:
技术优势:
首款集成ISF多标志物传感与超声心血管监测的可穿戴设备,突破CGM单模态局限。
机械鲁棒性(1000次弯曲后电阻漂移<0.5 Ω)和串扰抑制(<2%)支持日常使用。
临床价值:
实时预警运动性高血压、乳酸酸中毒等风险,为前驱糖尿病干预提供窗口期。
动脉硬度(AIx)作为血管健康指标,首次被纳入可穿戴糖尿病管理。
挑战与展望:
需大规模临床试验验证长期稳定性;未来可扩展至β-羟基丁酸、皮质醇等标志物。
系统功耗(617.92 mW)和全集成电路是下一阶段重点。结合机器学习,有望实现个性化胰岛素闭环给药。
[1] Chang, A.-Y. et al. Integration of chemical and physical inputs for monitoring metabolites and cardiac signals in diabetes.Nat.Biomed.Eng.(2025).
https://doi.org/10.1038/s41551-025-01439-z
END
编辑 | 乐活元 Fred
排版 | 张艳青
审核 | 医工学人理事会
扫码加入医工学人,进入综合及细分领域群聊,
参与线上线下交流活动

推荐阅读
点击关注医工学人

本篇文章来源于微信公众号: 医工学人