星标“医工学人”,第一时间获取医工交叉领域新闻动态~

长期以来,人类大脑复杂的淋巴系统一直难以捉摸。这个遍布全脑的类血管通路网络,负责脑脊液与脑间质液的交换,从而支持营养物质的输送和废物的清除,特别是与阿尔茨海默病和帕金森病等神经退行性疾病密切相关的蛋白质聚集体的清除。然而,由于现有技术侵入性强、高度定制化且时间分辨率低,对人脑淋巴系统功能的连续测量一直充满挑战。《Nature Biomedical Engineering》2025年5月27日发表的一项研究为我们展示了这一关键脑功能的检测新途径:一种非侵入性可穿戴设备,能够连续测量人脑实质电阻,并以此精准追踪淋巴功能。

01 大脑如何“清理垃圾”: 脑淋巴系统(glymphatic system) 脑淋巴系统是一个遍布全脑的血管周通路网络,脑部周围的脑脊液(CSF)通过该网络与脑间质液进行交换,从而支持营养物质的分布和废物的清除(如图1a,b所示)。在动物模型中,脑淋巴系统能够清除淀粉样蛋白 β、tau和 α-突触核蛋白: β-淀粉样蛋白(Aβ):与阿尔茨海默病密切相关 tau蛋白:异常聚集后可形成神经纤维缠结 α-突触核蛋白(α-synuclein):与帕金森病等运动障碍疾病有关 此外,脑淋巴系统还被推测参与神经递质(如乙酰胆碱、血清素、去甲肾上腺素)以及调节脑-体稳态的神经激素的体积传输(注:体积传输指的是神经信号分子如神经递质或激素,在脑组织液体环境中通过扩散或流动传播,而不是通过突触直接传递的过程)。
图1:淋巴功能与脑实质电阻的动态关联。 图1a:淋巴液循环示意图 淋巴功能涉及脑脊液沿着穿透动脉周围的血管周间隙流入,并与脑间质液交换。这种流动受动脉搏动、血管舒缩振荡和同步神经活动的驱动。 图1b:调节淋巴功能的生理因素 来自啮齿动物生理学研究的数据表明,淋巴功能在心率降低、血管舒缩搏动增加、EEG Beta波功率降低和EEG Delta波功率增加的条件下会增强。 图1c 和 1d:清醒与睡眠状态下的间质空间与电流路径 在清醒状态下(图1c),间质空间狭窄且扭曲,形成高阻抗路径,抑制淋巴流动。此时,低频电流主要通过间质液的电阻路径传播,而高频电流则能穿透细胞膜,通过总组织体积传播。在睡眠状态下(图1d),液体从细胞内转移到间质空间,使间质通路增宽,从而增强淋巴功能约60%。这种间质通路的拓宽降低了低频电流的阻抗,从而降低了测量到的介电色散。 图1e:阻抗-频率图 该图显示了清醒和睡眠状态之间介电色散的变化。脑实质电阻的变化与介电色散的相对变化成反比。 图1f:对比增强型MRI 静脉注射钆基造影剂(GBCA)后的CE-MRI显示,造影剂首先进入脑脊液,然后进入脑间质(绿色),而血管区域在注射后立即增强(红色)。MRI体素中的GBCA信号包含血液、脑脊液和脑间质液中的造影剂。 02 实时监测脑实质电阻的可穿戴设备 虽然脑淋巴系统被认为是清除大脑有害代谢物、维持脑健康的关键机制,但人类对其在体内的运行机制仍了解有限。目前对脑淋巴功能的评估主要依赖增强MRI,既成本高、操作复杂,又仅限于少数具备高端设备的研究中心,缺乏一种标准化、可重复、便捷的检测手段。这也使得基于脑淋巴功能进行疾病干预与早期诊断的构想,尚停留在理论阶段。为此,研究团队开发了一种可穿戴多模态设备,基于电阻抗谱(EIS)技术,通过头皮电极阵列,实现对脑实质电阻动态变化的连续监测。 技术 电阻抗谱(EIS) 增强MRI 时间分辨率 高(分钟级连续) 低(静态或分段) 成本与便携性 低,可穿戴 高,固定场所 安全性 非侵入式 有造影剂风险 应用场景 家庭、长期追踪 医院,短时评估
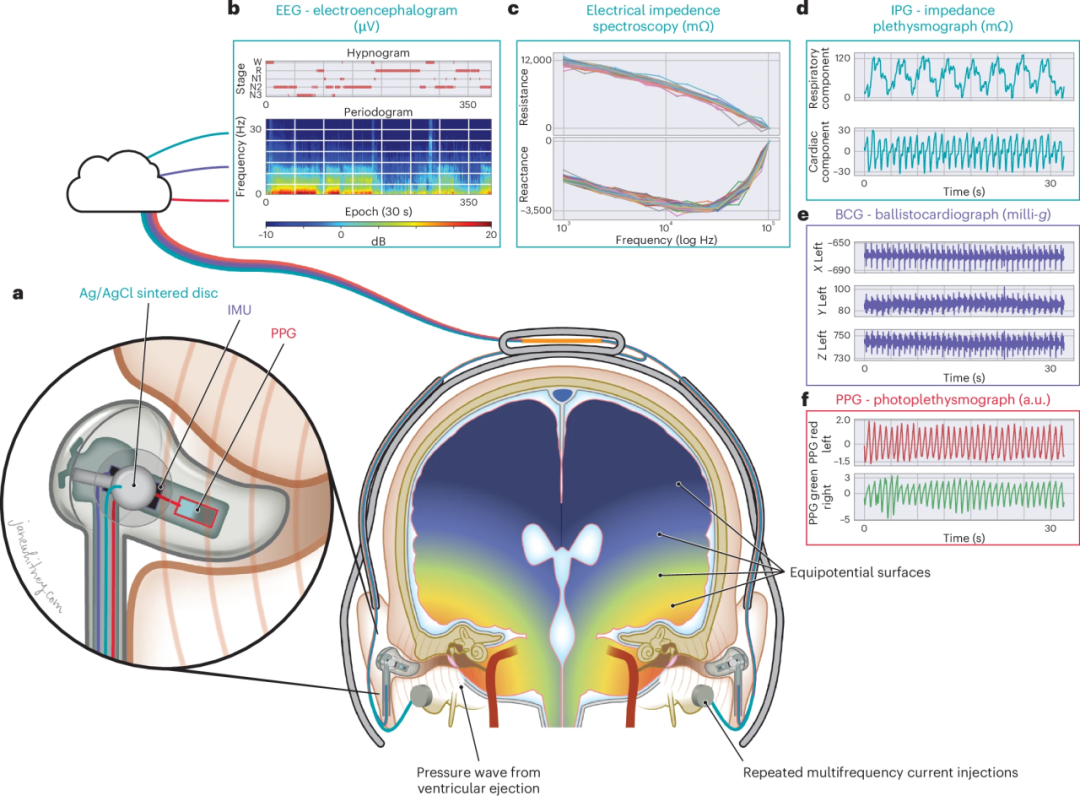
电阻抗谱(EIS)是一种成熟的生物电技术,已广泛应用于体脂评估、肿瘤变化监测、水肿检测等医学场景。其核心原理是在组织中注入交流电流,不同频率的电流在组织内的传播路径不同,从而反映细胞外与细胞内液体分布的差异:低频电流主要绕过细胞膜,仅流经细胞外间隙;而高频电流则能“穿透”细胞膜,进入细胞内部。这种随频率变化而发生的电响应现象被称为 β-介电弥散,其模式可揭示组织内水分布的动态变化。 研究团队提出,EIS 的这一本质特性可被用来“听见”脑内液体的细微变动,尤其是在睡眠期间脑淋巴系统活跃运作导致的液体转移。由于颅内体积总量恒定,频率响应的细微变化可被视为脑组织细胞外空间(即脑间质液)体积变化的间接指标,而这正是评估脑淋巴活性的关键窗口。 为实现这一想法,研究人员开发了一款可穿戴脑阻抗监测设备,能够在 1kHz 到 256kHz 之间进行高分辨率、多频段的连续测量,误差率控制在约 3%。该设备采用非传统的四电极配置,并配备低阻抗、非极化电极以减少运动伪影;同时引入屏蔽电缆、抑制杂散电容干扰,并通过信号处理算法精确区分真实生物信号与噪声。 工程难点 技术解决路径 电极-皮肤界面不稳定,尤其是夜间睡眠中 使用非极化电极+凝胶界面+四电极法,降低接触阻抗影响 高频段信号易受杂散电容干扰 优化设备布局与电缆屏蔽结构,抑制高频失真 多频测量过程中噪声叠加 采用实部/虚部校正算法,滤除伪信号干扰 小幅液体变化如何精确感知 设备在RP测量上精度误差仅为~3%,可追踪微小生理变化 这一技术平台不仅在稳定性和灵敏度上取得突破,更将脑淋巴功能的连续测量从影像学中心带到了可穿戴设备层面,为理解睡眠、大脑清除与神经退行性疾病之间的关联打开了全新通道。
图2:研究设备的技术原理图及其输出信号。 图2a:设备细节与传感器布局 此图展示了设备内部的传感器组件,包括Ag/AgCl烧结盘电极、惯性测量单元(IMU)和光电容积描记图(PPG)传感器。设备采用非传统四电极阻抗配置和低阻抗、非极化电极,以确保高保真测量并减少运动伪影和噪声。 图2b:EEG数据示例 该图显示了来自参与者佩戴设备时记录的脑电图(EEG)数据,包括睡眠分期图和周期图,展示了睡眠阶段的分布。 图2c:EIS阻抗与电抗频率图 该图揭示了睡眠期间介电色散的显著变化,证实了设备在测量脑实质电阻方面的能力。 图2d:IPG呼吸和心率成分 阻抗体积描记图(IPG)数据展示了呼吸和心脏活动引起的阻抗变化。 图2e:BCG数据 耳内惯性测量单元(IMU)能够检测到弹道心动图中的心脏射血,其J峰标志着主动脉瓣的开启。 图2f:PPG数据 光电容积描记图(PPG)测量了耳部的脉搏传导时间(PTT),提供了心血管功能的额外信息。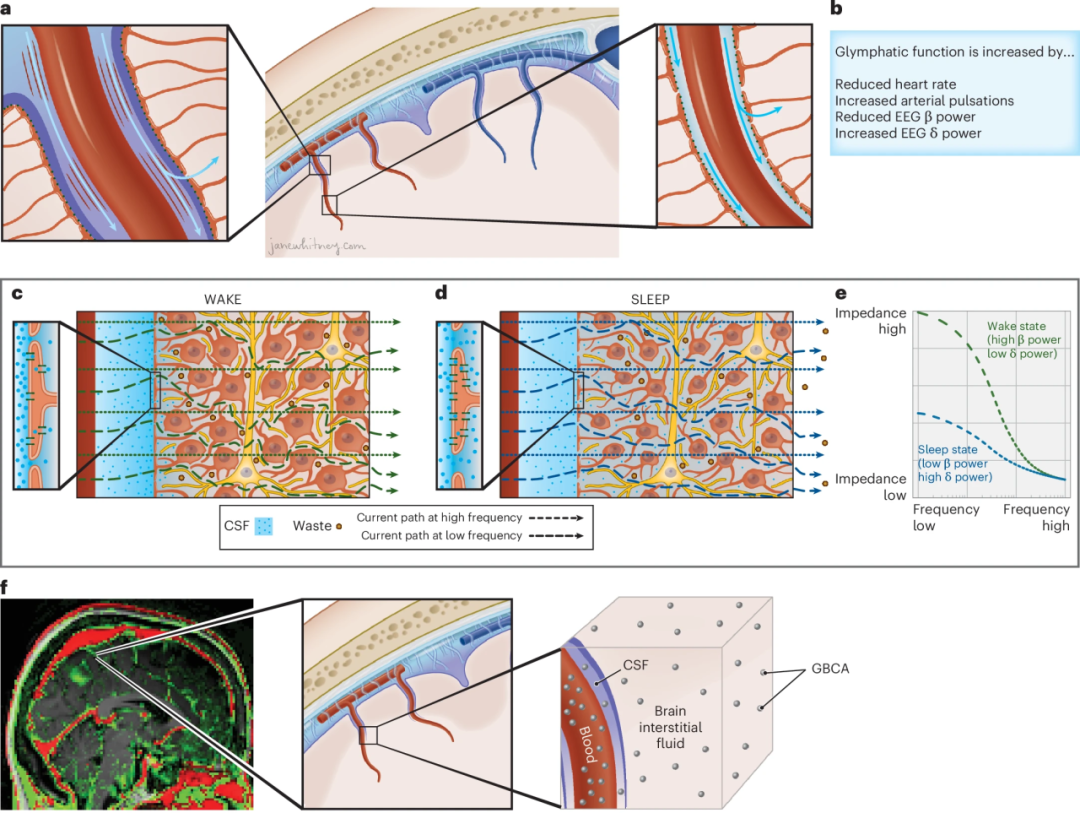
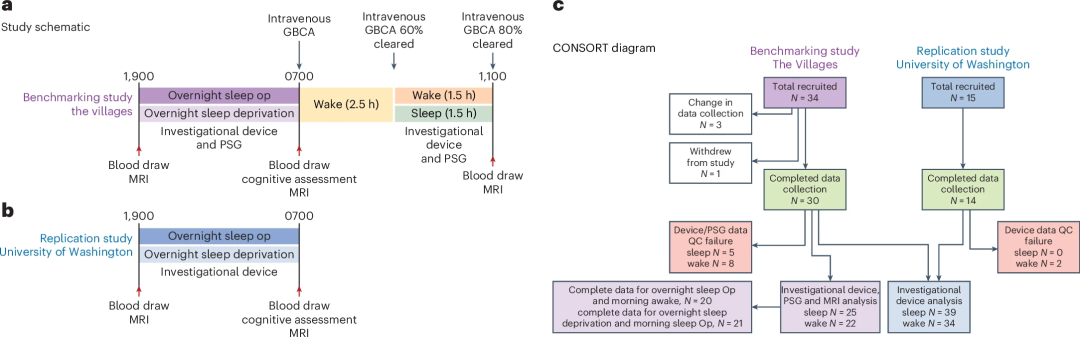
03 临床研究揭秘脑电活动与脑淋巴功能的关联 为了验证该设备的性能,研究团队开展了两项临床研究:基准研究(Benchmarking Study)和复制研究(Replication Study)。这两项研究均采用交叉试验设计,参与者分别经历一晚自然睡眠和一晚清醒状态。
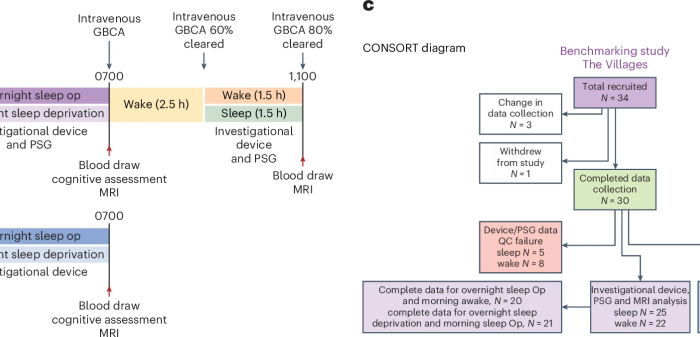
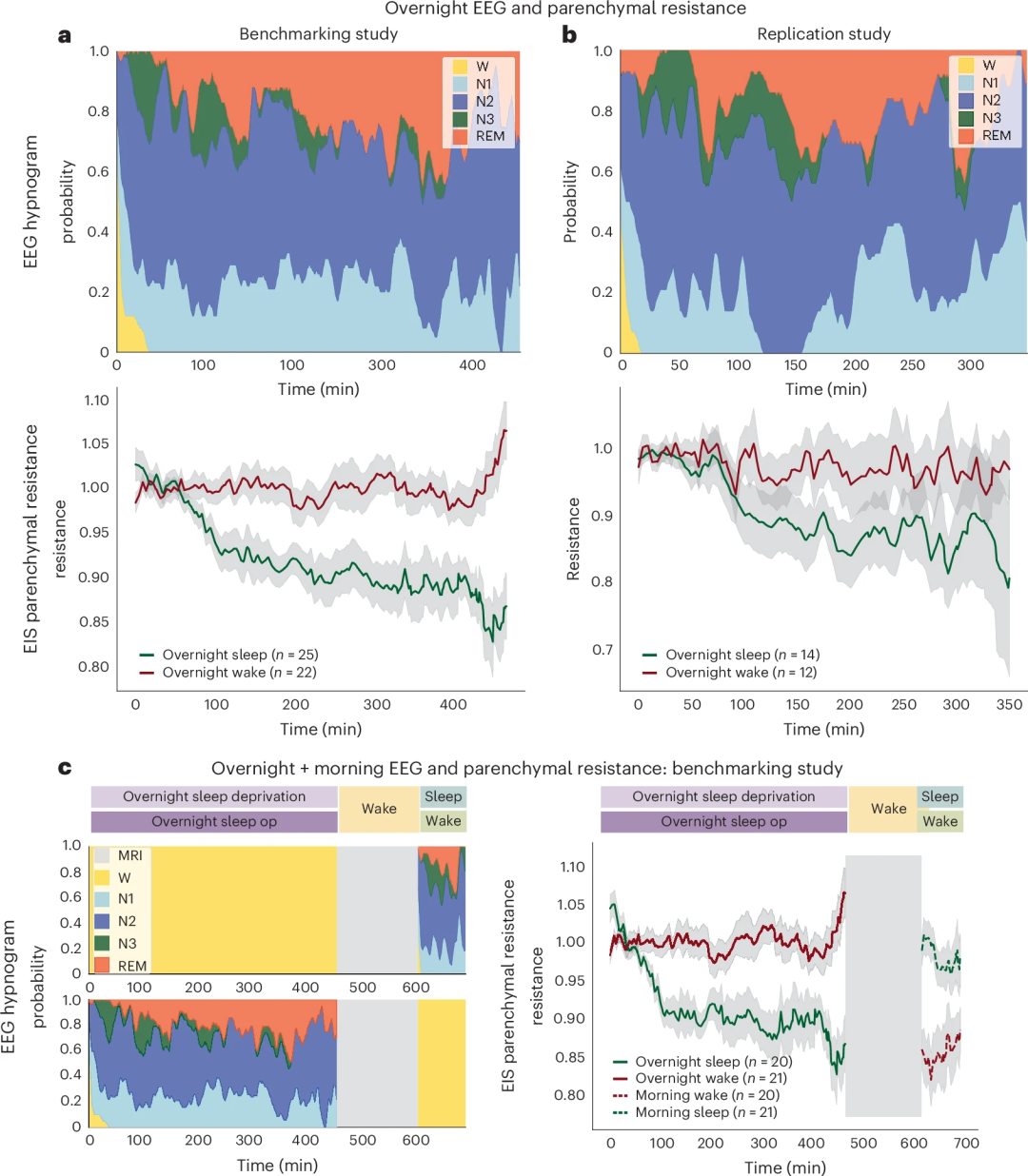
图3:研究设计与参与者流程 图3a:基准研究方案。基准研究在佛罗里达大学精准健康研究中心进行,旨在明确脑实质电阻 (Rp) 与脑淋巴功能之间的关系。研究包括夜间设备记录、金标准多导睡眠图(PSG)以及静脉注射GBCA后的早晨CE-MRI,用于评估淋巴功能。在早晨,经历一夜睡眠剥夺的参与者有1.5小时的睡眠机会,而正常睡眠的参与者则保持清醒。 图3b:复制研究方案。复制研究在华盛顿大学进行,主要目的是确认睡眠状态对设备测量Rp的影响,并次要确认Rp与睡眠阶段、心率和EEG光谱带功率之间的关联。 图3c:CONSORT研究流程图 详细展示了基准研究和复制研究的参与者招募、数据质量控制(QC)和最终纳入分析的数据集情况。 这项临床研究的主要结论是: 1、脑实质电阻 (Rp) 的变化与睡眠/觉醒状态密切相关: 在睡眠期间,Rp 会显著降低并单调下降;而在清醒期间,Rp 则保持恒定或有所增加。 2、Rp 与淋巴功能相关: 较低的夜间 Rp 与更强的淋巴功能(通过对比增强型 MRI 测量的更高对比增强)显著相关。 3、睡眠生理参数对淋巴功能的影响: 研究证实,较低的心率和较低的 Rp 预测了更大的对比增强。此外,EEG Beta 波功率的降低也预测了更大的脑实质增强,而较高的 EEG Delta 波功率和较低的 Rp 则预测了脑实质增强的减少(即更大的对比清除)。 这些发现共同表明,该无线设备测量的脑实质电阻能够有效追踪人类的淋巴功能,并且淋巴功能的变化与睡眠阶段、脑电图活动和心率等生理参数紧密关联。 图4:睡眠与觉醒状态下脑实质电阻的变化 图4a:基准研究的EEG睡眠图和Rp变化 顶部显示了基准研究中夜间睡眠期间的平均EEG睡眠图。底部显示了该时期内脑实质电阻(Rp)的变化,清醒状态下Rp保持恒定(红色),而睡眠状态下Rp逐渐下降(绿色)。 图4b:复制研究的EEG睡眠图和Rp变化 与基准研究观察到类似的趋势。 图4c:基准研究中夜间与早晨的EEG和Rp变化 左侧显示了夜间和早晨期间的平均EEG睡眠图。右侧显示了早晨清醒期间Rp逐渐增加(虚线红色),而睡眠期间Rp逐渐下降(虚线绿色)。 04 研究的意义、局限性 自2012年脑淋巴系统被发现以来,它迅速成为探索睡眠与认知功能、以及阿尔茨海默病等神经退行性疾病之间关系的研究热点。动物实验证实,脑淋巴功能受年龄增长、睡眠障碍、脑血管损伤和脑外伤等因素影响,功能受损会加速淀粉样蛋白和tau蛋白的沉积。临床研究也发现,其功能障碍与多种神经疾病存在遗传和组织学上的关联。然而,缺乏可用于人体的实时动态监测手段,长期制约了其在疾病机制研究中的进展。 本研究首次实现了人类脑淋巴功能的连续、非侵入式动态监测,并通过便携设备支持在家庭环境中长时间追踪,为脑健康管理提供了全新工具。该技术有望用于阿尔茨海默病等神经退行性疾病的早期筛查、疗效评估和疾病进展监测,助力精准干预。同时,这项成果也为建立“脑健康新生命体征”奠定了基础,推动神经科学与数字健康的深度融合。 当然,本研究也存在一定局限性。虽然脑脊液内注射的造影剂(GBCAs)增强MRI能提供更高信噪比和精细的脑淋巴图像,但出于临床安全性和规范考虑,本研究采用了静脉注射方式,导致时间分辨率较低但空间分辨率较高。相比之下,本文所开发的电阻抗设备虽空间分辨率较低,却实现了对脑实质阻抗的高时间分辨动态监测,成功捕捉了睡眠-觉醒状态下的淋巴功能变化,并揭示了相关神经生理驱动机制。 方法学上的不足包括:未直接测量或控制驱动脑淋巴运输的动力因素,如血管舒缩振荡、呼吸和心脏搏动量。此外,两项临床研究设计存在差异:基准研究中结合了增强MRI和金标准多导睡眠监测(PSG),而复制研究仅使用设备自带的脑电信号,且两者的受试者地域和年龄略有不同。尽管如此,经调整后两组数据在脑电和心率指标上仍表现出良好一致性,验证了设备测量的稳定性和可靠性。
END 撰文 | 张玉冰 编辑 | 王可豪 审核 | 医工学人理事会 扫码加入医工学人,进入综合及细分领域群聊,参与线上线下交流活动
推荐阅读


点击关注医工学人
本篇文章来源于微信公众号: 医工学人